Reaksi sikloadisi merupakan suatu reaksi pada dua molekul tak jenuh yang mengalami reaksi adisi untuk menghasilkan produk siklik. Dua molekul bergabung membentuk sebuah cincin. Dalam reaksi ini 2 ikatan phi diubah menjadi ikatan sigma.

Reaksi sikloadisi adalah reaksi dimana dua molekul tak jenuh (rangkap) mengadisi satu sama lain untuk menghasilkan produk siklik. Seperti reaksi elektrosiklik, sikloadsi dikendalikan oleh simetri orbital reaktan.
Reaksi sikloadisi Diels-Alder adalah proses perisiklik yang terjadi antara diena (empat elektron p) dan dienofil (dua elektron p) untuk menghasilkan produk sikloheksena. Reaksi dapat terjadi dengan mudah pada suhu kamar atau sedikit diatasnya dan bersifat stereospesifik terhadap substituen. Sebagai contoh, reaksi pada suhu kamar antara 1,3-butadiena dan dietil maleat (cis) menghasilkan produk sikloheksena yang tersubstitusi cis. Reaksi serupa antara 1,3-butadiena dan dietil fumarat (trans) menghasilkan produk sikloheksena yang tersubstitusi trans.
Reaksi di atas dianamakan reaksi sikloadisi Diels-Alder. dalam reaksi ini membentuk 2 ikatan karbon - karbon dalam satu tahap dan merupakan metode umum untuk membuat molekul siklik. Dalam reaksi ini, 2 reaktan bereaksi bersama sama melalui bentuk transisi siklik yang mana dua ikatan C-C baru terbentuk dalam waktu yang sama.
Reaksi sikloadisi Diels–Alder merupakan prosesperisiklik yang terjadi antara suatu diena (4 elektron phi) dan dienofil (2 elektron phi) untuk menghasilkan produk sikloheksena. Ada banyak contoh reaksi diels – alder, reaksi ini biasa terjadi dengan mudah pada temperatur ruangan atau sedikit di atasnya. Dan reaksi ini bersifat stereosepsifik terhadap substituennya.

Berbeda halnya dengan reaksi diels - alder [4 1 2]-p-electron, reaksi sikloadisi [4 1 2]-p-electron antara dua alkena itu tak bisa terjadi secara termal, dimana reaksi ini hanya bisa terjadi dengan bantuan irradiasi, yang akan menghasilkan produk siklobutana.

Untuk menghasilkan kesuksesan dalam reaksi diels – alder , terminal cuping phi dari 2 reaktan harus memiliki simetri yang benar untuk bisa menghasilkan ikatan baru. Hal ini bisa terjadi dalam 2 cara yang disebut dengan suprafacial dan antarafacial. Sikloadisi suprafacial terjadi ketika interraksi ikatan terjadi antara cuping pada muka yang sama dari satu reaktan dan cuping pada muka yang sama dari reaktan lainnya. Sedangkan, pada sikloadisi antarafacial terjadi ketika interaksi ikatannya terjadi antara cuping pada muka yang sama dari satu reaktan dan cuping muka berlawanan pada reaktan lainnya. Seperti pada gambar. Perlu diperhatikan bahwa keduanya merupakan symmetri-allowed.
Sikloadisi etilena atau dua antena sederhana yang disebut sikloadisi 2 + 2 karena terlibatnya 2 elektron phi ditambah 2 elektron phi. Reaksi diels alder merupakan contoh suatu sikloadisi 4 + 2, dienanya mengandung 4 elektron.
Sikloadisi (2+2)
Reaksi sikloadisi tipe (2+2) mudah terjadi dengan adanya cahaya dengan panjang gelombang yang sesuai tetapi tidak mudah terjadi apabila campuran reaksi itu dipanaskan. Mudah dijelaskan dengan teori orbital garis depan dengan mengandaikan bahwa elektron elektron mengalir dari homo satu molekul ke limo molekul lainnya. Pada sikloadisi (2+2) etilena yang menghasilkan siklobutana. Etilena mempunyai dua orbital π:π*.
Dalam suatu reaksi sikloadisi homo dari molekul pertama harus bertumpang tindih dengan lumba dari molekul kedua. Hal ini karena homo pada molekul pertama tidak bertumpang tindih dengan homo molekul kedua karena orbital tersebut telah terisi bersamaan dengan menyatunya orbital π. Orbital-orbital ini juga mengalami hibridisasi menghasilkan ikatan ikatan sigma sp³ baru.
Dalam suatu reaksi sikloadisi homo dari molekul pertama harus bertumpang tindih dengan lumba dari molekul kedua. Hal ini karena homo pada molekul pertama tidak bertumpang tindih dengan homo molekul kedua karena orbital tersebut telah terisi bersamaan dengan menyatunya orbital π. Orbital-orbital ini juga mengalami hibridisasi menghasilkan ikatan ikatan sigma sp³ baru.
Sikloadisi (4+2)
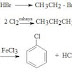
Sikloadisi (4+2) disebut juga Reaksi Diels–Alder. Dua angka tersebut melambangkan jumlah elektron pi yang terlibat dalam suatu reaksi sikloadisi. Berikut ini contoh sederhana reaksi sikloadisi:
Reaksi Diels Alder merupakan reaksi sikloadisi yang bergantung pada suhu dan mekanismenya melibatkan tumpang tindih antara orbital σ dan orbital π. Reaksi ini terjadi antara molekul dengan dua ikatan rangkap dua terkonjugasi (diena) dan molekul dengan satu ikatan rangkap dua (dienofil) serta menghasilkan dua ikatan karbon-karbon yang baru dan satu molekul sikoheksana yang tidak jenuh dalam satu langkah.


Reaksi Diels–Alder disebut juga sikloadisi (4+2) karena cincin terbentuk oleh interaksi 4 elektron π pada diena dan 2 elektron π pada alkena atau alkuna. Reaksi sikloadisi adalah reaksi dimana dua molekul bergabung membentuk sebuah cincin. Dalam reaksi Diels-Alder, diena adalah gugus yang kaya elektron, sedang dienofil (diene-lover) adalah gugus yang miskin elektron.
Dari pemaparan di atas, maka timbulah permasalahan antara lain:
- Reaksi Diels-Alder terjadi dengan diena berada pada konformasi cis atau endo, diena dalam konformasi trans seringkali menjadi susah bereaksi dengan dienofil atau bahkan tidak bereaksi. Mengapa demikian?
- Kenapa pada suatu reaksi sikloadisi, HOMO dari molekul pertama harus bertumpangtindih dengan LUMO dari molekul kedua?
- Kenapa reaksi sikloadisi tipe (2+2) misalnya etilena mudah terjadi dengan adanya cahaya dengan panjang gelombang yang sesuai tetapi tidak mudah terjadi apabila campuran reaksi itu dipanaskan?
Referensi:
Fessenden, R.J dan J.S. Fessenden. 1982. Kimia Organik Edisi Ketiga. Jakarta : Erlangga.





Makasih ajoo paparannya,
BalasHapus1. Karena kemungkinan terjadinya tumpang tindih antara orbital π dari diena dalam konformasi trans dengan orbital π dari dienofil terlalu kecil.
2. Karena HOMO dari molekul pertama tidak dapat bertumpang tindih dengan HOMO dari molekul kedua
3. Karena elektron π nya tidak dipromosikan tetapi tetap dalam keadaan dasar π1.
Makasih kal
BalasHapus2. Karena HOMO dari molekul pertama tidak dapat bertumpang tindih dengan HOMO dari molekul kedua
3. Karena elektron π nya tidak dipromosikan tetapi tetap dalam keadaan dasar π1.
3. Karena elektron π nya tidak dipromosikan tetapi tetap dalam keadaan dasar π1.
BalasHapusMakasih kal
BalasHapus2. Karena HOMO dari molekul pertama tidak dapat bertumpang tindih dengan HOMO dari molekul kedua
3. Karena elektron π nya tidak dipromosikan tetapi tetap dalam keadaan dasar π1.
Halo haikal, jawaban untuk pertanyaan no 3: Karena elektron π nya tidak dipromosikan tetapi tetap dalam keadaan dasar π1.
BalasHapusmaaciw eeaa haecal paparannya,
BalasHapus1. Karena kemungkinan terjadinya tumpang tindih antara orbital π dari diena dalam konformasi trans dengan orbital π dari dienofil terlalu kecil.
2. Karena HOMO dari molekul pertama tidak dapat bertumpang tindih dengan HOMO dari molekul kedua
3. Karena elektron π nya tidak dipromosikan tetapi tetap dalam keadaan dasar π1
Yuhuuuu
BalasHapusJawaban untuk pertanyaan no 3: Karena elektron π nya tidak dipromosikan tetapi tetap dalam keadaan dasar π1.
hai haikal...
BalasHapus2. Karena HOMO dari molekul pertama tidak dapat bertumpang tindih dengan HOMO dari molekul kedua
2. Karena HOMO dari molekul pertama tidak dapat bertumpang tindih dengan HOMO dari molekul kedua
BalasHapus3. Karena elektron π nya tidak dipromosikan tetapi tetap dalam keadaan dasar π1
1. Karena kemungkinan terjadinya tumpang tindih antara orbital π dari diena dalam konformasi trans dengan orbital π dari dienofil terlalu kecil.
BalasHapus2. Karena HOMO dari molekul pertama tidak dapat bertumpang tindih dengan HOMO dari molekul kedua
3. Karena elektron π nya tidak dipromosikan tetapi tetap dalam keadaan dasar π1.
1. Karena kemungkinan terjadinya tumpang tindih antara orbital π dari diena dalam konformasi trans dengan orbital π dari dienofil terlalu kecil.
BalasHapus2. Karena HOMO dari molekul pertama tidak dapat bertumpang tindih dengan HOMO dari molekul kedua
Mksih haikal. Saya covajawab no 1. Karena kemungkinan terjadinya tumpang tindih antara orbital π dari diena dalam konformasi trans dengan orbital π dari dienofil terlalu kecil.
BalasHapus1. Karena kemungkinan terjadinya tumpang tindih antara orbital π dari diena dalam konformasi trans dengan orbital π dari dienofil terlalu kecil.
BalasHapusoke... jadi tu dak kal no.3. Karena elektron π nya tidak dipromosikan tetapi tetap dalam keadaan dasar π1.
BalasHapusTerimakasih haikal
BalasHapus1. Karena kemungkinan terjadinya tumpang tindih antara orbital π dari diena dalam konformasi trans dengan orbital π dari dienofil terlalu kecil.
2. Karena HOMO dari molekul pertama tidak dapat bertumpang tindih dengan HOMO dari molekul kedua
Untuk jawaban nomor 2 Karena HOMO dari molekul pertama tidak dapat bertumpang tindih dengan HOMO dari molekul kedua
BalasHapus1. Karena kemungkinan terjadinya tumpang tindih antara orbital π dari diena dalam konformasi trans dengan orbital π dari dienofil terlalu kecil.
BalasHapus2. Karena HOMO dari molekul pertama tidak dapat bertumpang tindih dengan HOMO dari molekul kedua
Terima kasih,
BalasHapusBaiklah saya akan membantu menjawab pertanyan nomor, yaitu Karena kemungkinan terjadinya tumpang tindih antara orbital π dari diena dalam konformasi trans dengan orbital π dari dienofil terlalu kecil.
Terimakasih haekal
BalasHapus2. Karena HOMO dari molekul pertama tidak dapat bertumpang tindih dengan HOMO dari molekul kedua
3. Karena elektron π nya tidak dipromosikan tetapi tetap dalam keadaan dasar π1.
1. Karena kemungkinan terjadinya tumpang tindih antara orbital π dari diena dalam konformasi trans dengan orbital π dari dienofil terlalu kecil.
BalasHapus2. Karena HOMO dari molekul pertama tidak dapat bertumpang tindih dengan HOMO dari molekul kedua
3. Karena elektron π nya tidak dipromosikan tetapi tetap dalam keadaan dasar π1.
1. Karena kemungkinan terjadinya tumpang tindih antara orbital π dari diena dalam konformasi trans dengan orbital π dari dienofil terlalu kecil.
BalasHapus2. Karena HOMO dari molekul pertama tidak dapat bertumpang tindih dengan HOMO dari molekul kedua
3. Karena elektron π nya tidak dipromosikan tetapi tetap dalam keadaan dasar π1.
1. Karena kemungkinan terjadinya tumpang tindih antara orbital π dari diena dalam konformasi trans dengan orbital π dari dienofil terlalu kecil.
BalasHapus2. Karena HOMO dari molekul pertama tidak dapat bertumpang tindih dengan HOMO dari molekul kedua
1. Karena kemungkinan terjadinya tumpang tindih antara orbital π dari diena dalam konformasi trans dengan orbital π dari dienofil terlalu kecil.
BalasHapus2. Karena HOMO dari molekul pertama tidak dapat bertumpang tindih dengan HOMO dari molekul kedua
3. Karena elektron π nya tidak dipromosikan tetapi tetap dalam keadaan dasar π1.
1. Karena kemungkinan terjadinya tumpang tindih antara orbital π dari diena dalam konformasi trans dengan orbital π dari dienofil terlalu kecil.
BalasHapus2. Karena HOMO dari molekul pertama tidak dapat bertumpang tindih dengan HOMO dari molekul kedua
3. Karena elektron π nya tidak dipromosikan tetapi tetap dalam keadaan dasar π1.
Terimakasih haekal
BalasHapus2. Karena HOMO dari molekul pertama tidak dapat bertumpang tindih dengan HOMO dari molekul kedua
3. Karena elektron π nya tidak dipromosikan tetapi tetap dalam keadaan dasar π1.
1. Karena kemungkinan terjadinya tumpang tindih antara orbital π dari diena dalam konformasi trans dengan orbital π dari dienofil terlalu kecil.
BalasHapus2. Karena HOMO dari molekul pertama tidak dapat bertumpang tindih dengan HOMO dari molekul kedua
3. Karena elektron π nya tidak dipromosikan tetapi tetap dalam keadaan dasar π1.
2. Karena HOMO dari molekul pertama tidak dapat bertumpang tindih dengan HOMO dari molekul kedua
BalasHapus